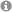Die Verteilung von Nanopartikeln in Geweben und Organen

Nanopartikel Verteilung in der hinteren Augenkammer. Die Nanopartikel (rot) reichern sich in den Endothelzellen der Choriocapillaris1 (CC) an. Sclera (S); retinales Pigment Epithel (RPE). Fluoreszierende Nanopartikel (rot); DAPI-Zellkern-F?rbung (blau); Gewebe Autofluoreszenz (grau). (Abbildung aus: Pollinger et al. Proc. Natl. Acad. Sci. 2013, 110, 6115–6120, www.pnas.org/content/110/15/6115).
Nanopartikel unterliegen aufgrund ihrer Gr??e und physikochemischen Eigenschaften einer eingeschr?nkten Verteilung im Organismus. bwin娱乐_bwin娱乐官网欢迎您@ stellt im Rahmen der Therapie ein gravierendes Handicap dar. Eine Ausnahme sind Tumore, in die Nanopartikel über sog. fenesterierte Endothelien eindringen k?nnen. In den malignen Geweben entstehen solche ?ffnungen durch pathologische Ver?nderungen von Blutgef??en, insbesondere von Kapillaren. Fenestrierte Endothelien kommen aber auch unter physiologischen Bedingungen in einer Reihe von Geweben vor, so zum Beispiel in den Glomeruli der Niere oder in der Aderhaut der Retina. In beiden F?llen k?nnte die Therapie einer Reihe von Erkrankungen enorm von der F?higkeit therapeutischer Nanopartikel, den Blutkreislauf gezielt verlassen zu k?nnen, profitieren. Ziel unserer Arbeiten ist es zu verstehen, welche Eigenschaften es Nanopartikeln nach parenteral Applikation erlaubt nicht-maligne Gewebe zu erreichen.
Multivalent und heteromultivalent bindende Nanopartikel

Sagittal eye sections of mice that received 200 pmol either ligand-decorated (right figure) or or ligand-free quantum dot (Qdot) nanoparticles (right figure). Upon systemic administration only EXP3174-modified Qdots accumulated in the choriocapillaris and in intraretinal capillaries of the posterior eye. (CC: choriocapillaris, RPE: retinal pigment epithelium, OS: outer segment, IS: inner segments, ONL: outer nuclear layer, OPL: outer plexiform layer, INL: inner nuclear layer, fluorescent nanoparticles (red); DAPI nuclei staining (blue); tissue autofluorescence (gray). (Figure taken from: Hennig et al., Multivalent nanoparticles bind the retinal and choroidal vasculature. Journal of controlled release 220 (2015) 265–274. DOI: 10.1016/j.jconrel.2015.10.033).
Ein derzeit vielbeachtetes Thema im Bereich Nanomaterialien zur Applikation von Arzneistoffen ist die Anwendung von Nanopartikeln zur gezielten Interaktion mit Rezeptoren an der Zelloberfl?che. Für diese als direktes Targeting bezeichnete Strategie werden in der Regel selektive Liganden für Oberfl?chenrezeptoren der Zielzelle in der Corona von Nanopartikeln immobilisiert mit dem Ziel deren Avidit?t für die Zielzelle zu erh?hen.
Durch die Anbindung von Liganden an die Partikeloberfl?che, aber auch durch die gleichzeitige Pr?sentation, ?ndern sich allerdings eine Reihe von Eigenschaften gegenüber den genuinen Liganden. Einerseits bü?en Liganden durch die Anbindung an Materialoberfl?chen einen Teil ihrer F?higkeit ein, mit hoher Affinit?t an den Zielrezeptor zu binden. Andererseits k?nnen derartige Ligand-modifizierte Nanopartikel koordiniert an mehreren Rezeptoren gleichzeitig binden, was den Affinit?tsverlust kompensieren und die Avidit?t sogar erh?hen kann. Ziel der Arbeiten ist es, die Mechanismen dieser multivalenten Bindung eingehend zu untersuchen und zu verstehen, welche Avidit?t für die Bindung der Nanopartikel an die Zielzelle resultiert.
Ein weiterer Aspekt der Arbeiten sind sogenannte Off-Target Zellen, die ggf. denselben Rezeptor wie die Zielzelle tragen und durch Bindung einfach dotierter Nanopartikel deren Zielgenauigkeit mindern. Viren als ?natürliche“ Nanopartikel umgehen dieses Problem, indem sie an mehrere unterschiedliche Rezeptoren binden, um damit die Zielzelle zu identifizieren. Gegenstand der Forschungsarbeiten ist es, dieses Prinzip biomimetisch auf Nanopartikel zu übertragen, um dadurch die Spezifit?t für die Zielzelle zu steigern. bwin娱乐_bwin娱乐官网欢迎您@ soll durch die Bindung mehrerer Liganden für unterschiedliche Rezeptoren an Nanopartikel erreicht werden, die ?hnlich wie im Falle von Viren nicht gleichzeitig, sondern zeitlich versetzt pr?sentiert werden.